⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。表达式:___________ 。

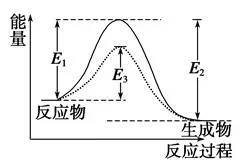
图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为应的活化能)
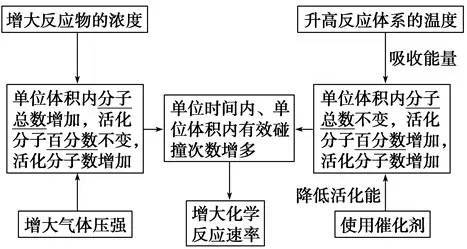
1、化学平衡状态:一定条件(恒温、恒容或恒压)下的可应里,正反应和应的速率相等,反应混合物(包括反应物和生成物)中各组分的浓度保持不变的状态。
可应中旧化学平衡的、新化学平衡的建立,由原平衡状态向新化学平衡状态的过程,称为化学平衡的移动。
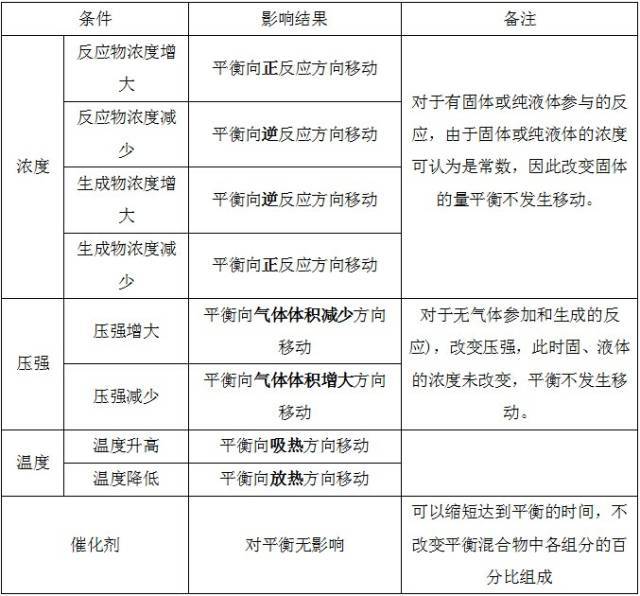

原理适用的范围:已达平衡的体系、所有的平衡状态(如溶解平衡、化学平衡、电离平衡、水解平衡等)和只限于改变影响平衡的一个条件。
勒夏特列原理中“减弱这种改变”的解释:条件改变使平衡发生移动的结果,是减弱对这种条件的改变,而不是抵消这种改变,也就是说:因素对平衡体系的影响占主要方面。

③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4 为强电解质)——电解质的强弱与导电性、溶解性无关。
3、电离平衡:在一定的条件下,当电解质电离成 离子的速率 和离子结合成 时,电离过程就达到了 平衡状态 ,这叫电离平衡。
B、浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
6、电离:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的浓度的比是一个。叫做电离平衡,(一般用Ka表示酸,Kb表示碱。)
变色范围:甲基橙3.1~4.4(橙色) 石蕊5.0~8.0(紫色) 酚酞8.2~10.0(浅红色)
1、强酸与强酸的混合:(先求[H+]混:将两种酸中的H+离子物质的量相加除以总体积,再求其它) [H+]混=([H+]1V1+[H+]2V2)/(V1+V2)
2、强碱与强碱的混合:(先求[OH-]混:将两种酸中的OH‑离子物质的量相加除以总体积,再求其它) [OH-]混=([OH-]1V1+[OH-]2V2)/(V1+V2) (注意:不能直接计算[H+]混)
3、强酸与强碱的混合:(先据H++ OH-==H2O计算余下的H+或OH-,①H+有余,则用余下的H+数除以溶液总体积求[H+]混;OH-有余,则用余下的OH-数除以溶液总体积求[OH-]混,再求其它)
(1)仪②滴定管的刻度,O刻度在上 ,往下刻度标数越来越大,全部容积 大于 它的最大刻度值,因为下端有一部分没有刻度。滴定时,所用溶液不得超过最低刻度,不得一次滴定使用两滴定管酸(或碱),也不得中途向滴定管中添加。②滴定管可以读到小数点后 一位 。
准备:检漏、洗涤、润洗、装液、赶气泡、调液面。(洗涤:用洗液洗→检漏:滴定管是否漏水→用水洗→用标准液洗(或待测液洗)→装溶液→排气泡→调液面→记数据V(始)
上述公式在求算浓度时很方便,而在分析误差时起主要作用的是上的V酸的变化,因为在滴定过程中c酸为标准酸,其数值在理论上是不变的,若稀释了虽实际值变小,但体现的却是V酸的增大,导致c酸偏高;V碱同样也是一个定值,它是用标准的量器量好后注入锥形瓶中的,当在实际操作中碱液外溅,其实际值减小,但引起变化的却是标准酸用量的减少,即V酸减小,则c碱降低了;对于观察中出现的误差亦同样如此。综上所述,当用标准酸来测定碱的浓度时,c碱的误差与V酸的变化成正比,即当V酸的实测值大于理论值时,c碱偏高,反之偏低。
2、水解的实质: 水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,水的电离,是平衡向右移动,促进水的电离。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。 (如:Na2CO3>NaHCO3)
③酸碱:促进或盐的水解(H+促进 阴离子 水解而 阳离子水解;OH-促进阳离子水解而阴离子水解)
(1)构成盐的离子均能发生水解的反应。双水解反应相互促进,水解程度较大,有的甚至水解完全。使得平衡向右移。
对于强碱弱酸盐:Kh=Kw/Ka(Kw为该温度下水的离子积,Ka为该条件下该弱酸根形成的弱酸的电离平衡)
对于强酸弱碱盐:Kh=Kw/Kb(Kw为该温度下水的离子积,Kb为该条件下该弱碱根形成的弱碱的电离平衡)
①电荷守恒::任何溶液均显电 中 性,各阳离子浓度与其所带电荷数的乘积之和=各阴离子浓度与其所带电荷数的乘积之和
(2)反应后离子浓度降至1*10-5以下的反应为完全反应。如酸碱中和时[H+]降至10-7mol/L10-5mol/L,故为完全反应,用“=”,常见的难溶物在水中的离子浓度均远低于10-5mol/L,故均用“=”。
1)、定义:在一定条件下,难溶电解质电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。
(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(3)三看是否形成闭合回,形成闭合回需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。
ps:附中名师的,在你的学习道上祝你一臂之力。高考已经结束,准高三的同学,要抓紧时间了,距高考也不到一年了,从现在开始,为了,加入90+训练营!!!返回搜狐,查看更多







